栄養素とC/Nバランスとは?
偏食や過食による体内栄養バランスの乱れが原因となり引き起こされる「メタボリックシンドローム」は,現代人の大きな関心事の一つです。
同様に,植物が生存するうえでも栄養のバランスを保つことは重要です。ただし,人間が栄養源となる食べ物を自分で選択できるのに対して,地表に固定され動けない植物は,自らが生存している場所での栄養環境に適応していかなければなりません。
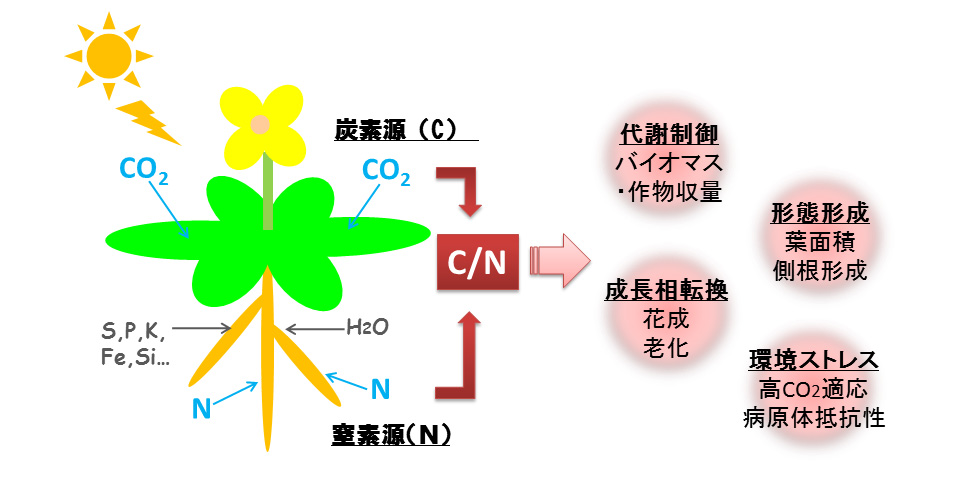
特に,炭素源(C)である糖と主要栄養素である窒素(N)の獲得は植物の発生・成長を大きく左右します。これらは,タンパク質合成を代表として,物質代 謝の全体において密接に関わりあっています。つまり植物は,光合成により葉で作り出された糖と,根から吸収した窒素源をより効率よく分配し,代謝に利用す る必要があります。そのため,植物は,炭素と窒素の代謝調節に関する個別のシグナリング機構に加えて,細胞内の炭素および窒素代謝物の相対量比(C/Nバ ランス)を感知し,環境に適応する能力,すなわちC/N応答機構を備えています。「C/N」は細胞内の基幹代謝,さらには植物のライフサイクル転換を制御する重要なシグナルとなります。また近年,世界規模での環境問題でもある大気中CO2濃度増加という観点からも,C/Nによる植物の成長制御が注目されています(図1)。
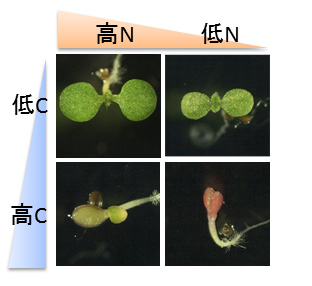
C/Nバランスが植物の成長を制御している例をシロイヌナズナで示しましょう(図2)。
高い糖濃度かつ低い窒素濃度 (高C/低N) 条件下では植物の生育は著しく阻害されますが,同じ糖濃度でも,そこに窒素を添加することで生育阻害は緩和されます(高C/高N)。逆 に,同じ低窒素濃度でも糖の量を減らすことで同様のストレス緩和効果がみられます(低C/低N)。つまり,CとNそれぞれ単独の存在量ではなく,相対的なC/Nバランスが植物の発芽後成長を制御する重要な因子になっていることが分かります。
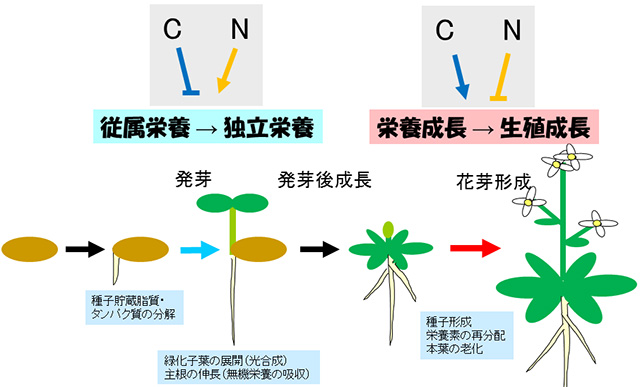
C/Nは発芽後成長だけではなく,栄養成長相から生殖成長相への転換点である「花成」や老化といった植物のライフサイクル全般のチェックポイントにおいても重要な因子であることが分かってきています(図3)。
また,花成や老化の制御においては「高C/低N」でより促進的な効果を有することが分かってきており,発芽後成長とは逆になることも興味深い点です。
C/Nが植物の発芽後成長や花成といった成長相を制御する因子として重要なことは古くから知られており,農業的な観点でも利用されてきました。
その一方 で,そのシグナリング機構の分子実体については未だに謎のままでした。
C/N応答制御の分子メカニズムとは?
これまでの研究から,植物におけるC/Nバランスセンサー候補として,2-オキソグルタル酸(2-OG)結合活性を有する大腸菌PII分子のシロイヌナズナホモログであるAtGLB1やグルタミン酸受容体であるAtGLR1.1が報告されていました。
2-OGはクエン酸回路の代謝中間体であり,また直接アミノ酸合成経路に利用される化合物です。根で吸収された窒素源は,グルタミン-グルタミン酸合成 回路を経て,アミノ酸に合成されます。2-OGは,その際,アミノ基を受容する炭素骨格として利用されます。従って,これら2つの候補分子はいずれも炭素 代謝と窒素代謝経路の相互作用点に関わる分子として注目されていました。大腸菌においては,PIIタンパク質がC/Nセンサーとして機能すると考えられて います。つまり,AtGLB1およびAtGLR1.1はいずれも代謝的側面あるいは他の生物種での研究からその重要性が予想されたものです。
植物においても両遺伝子を対象とした遺伝学的解析が行われてきましたが,C/Nセンサーとしての検証は未だ不完全なままです。従って,植物におけるC /N応答機構の実態については多くの謎が残されたままでした。そのため,新たなC/Nセンサーおよびシグナリング分子候補の発見が待たれていました。
私たちの研究から,植物C/N応答制御機構において「ユビキチンカス ケード‐プロテアソームシステム(以下UPS)」を介した能動的タンパク質分解が重要な役割を果たすことが発見されました。
C/N応答異常変異体の発見
~ユビキチン‐プロテアソームシステムによる栄養応答制御~
そこで私たちの研究室では,新規C/N応答異常変異体の単離を目指し,独自のC/Nストレス培地を用いたスクリーニングを行ってきました。
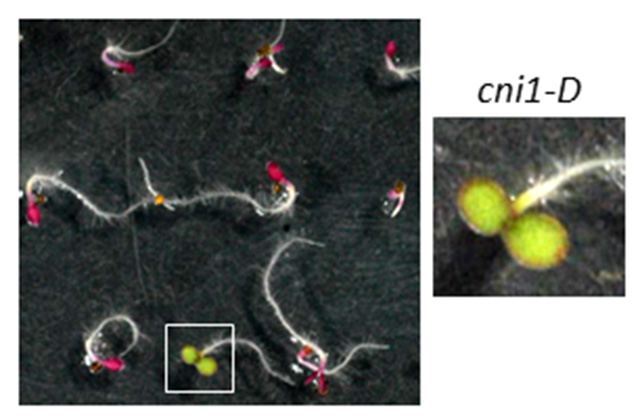
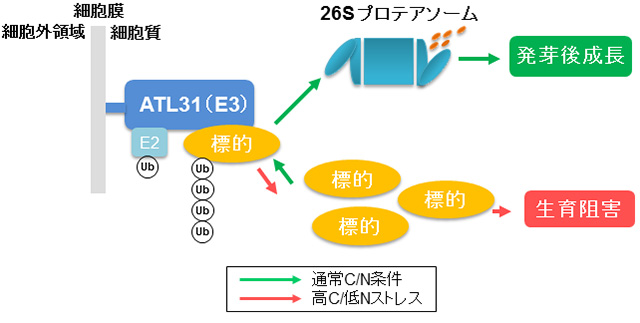
理化学研究所植物科学センターが開発したシロイヌナズナ機能獲得型変異体FOX(Full-length cDNA OvereXpressor)ラインを材料に,これまで,約6,000ラインのスクリーニングを行ってきました。その結果,この培地で耐性を示すC/N応 答異常変異体”carbon/nitrogen insensitive 1-D (cni1-D)”が得られました。cni1-D変異体は,野生型植物が枯死するような高C/低Nストレス条件でも子葉の緑化が観察され,C/Nストレス耐性を示しました(図4)。上記変異体は原因遺伝子CNI1の過剰発現が原因でしたが,この遺伝子の機能欠損変異体では,逆にC/Nストレスに過剰応答を示しました。これらの結果から,CNI1はC/N応答制御分子であることが示唆されました。原因遺伝子CNI1をクローニングし同定した結果,RING-H2型のユビキチンリガーゼ(E3)であるATL31タンパク質をコードしていることが判りました。
ユビキチンリガーゼはUPSの鍵となる分子です。ユビキチンリガーゼは,分解されるべき標的タンパク質を直接捕捉し,E1,E2を経て受け渡されたユビキ チン分子を最終的に標的タンパク質に付加し ます(図2)。つまり,分解されるべき標的タンパク質の特異性を決定する非常に重要な機能をもち,UPSを介したシグナリング機構の根幹を担っています。 植物では全ゲノムの5%にあたる約1,200遺伝子がユビキチンリガーゼをコードしており,その多様性が植物のもつ優れた環境適応能力の一翼を担うと考え られています。ATL31は実際にユビキチンリガーゼ活性を有することも確認されています。また,このATL31のRINGドメインに変異を入れ,ユビキ チン 活性を欠損させた場合,その植物のC/N耐性は失われます。こうした知見から,ATL31はユビキチンリガーゼとして植物C/N応答を制御する分子 であることが示唆されました(図5)。また,ATL31のユビキチン化標的タンパク質はC/Nシグナリング機構の中核を担うことが予想されました。つま り, 標的タンパク質の同定も含めて,ユビキチンリガーゼATL31とその活性制御に関わる分子の機能解明は,長年不明であった植物C/N応答機構の実体解明に 直結する可能性が高いと考えられています(Sato et al., Plant J, 2009, 60: 852-864)。
さらに,この発見と時期を同じくして,糖と窒素,個別のシグナリングに関してもUPSを介した制御機構の存在が相次いで報告されました。1つは,植物ホルモ ンであるアブシジン酸(ABA)のシグナル伝達に関わるユビキチンリガーゼKEGであり,この分子の機能欠損変異体では糖に対する応答および発芽後成長が 異常になることが示されています。加えて,低窒素条件下での生育が不良になる変異体の原因遺伝子NLAもまたユビキチンリガーゼをコードしていました。両 分子は実際にユビキチンリガーゼ活性を有することが示されており,KEGについては既にABAシグナリングに関わるABI5がユビキチン化の標的タンパク 質として同定されています。C/N応答制御ユビキチンリガーゼATL31に加えて,KEGやNLAの発見により,これまで明らかとなっていなかった栄養環 境 に対する応答においても,UPSが重要な役割を果たすことが示されました。
ユビキチンリガーゼATL31と多機能因子14-3-3によるC/N応答制御
タンパク質のドメイン構造から,CNI1は ATLファミリーと名づけられたユビキチンリガーゼファミリーの一員,ATL31であることが分かりました。
しかし,ATL31の生化学的機能は未知の状態であり,ATL31のユビキチン化ターゲットは何か?これを つきとめることが次の重要課題でした。
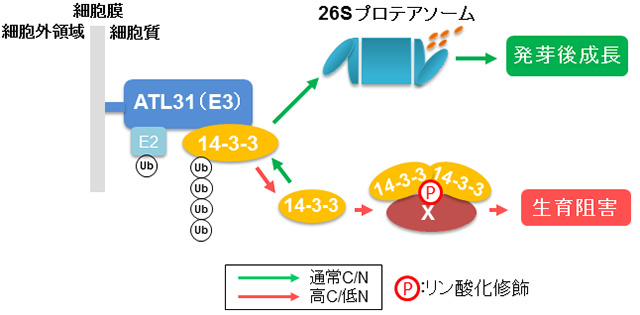
そこで,FLAGタグを用いたアフィニティー精製とMS解析によるATL31相互作用因子 の探索を行いました。また,より効果的にユビキチン化標的を捕捉するために,上述のRING変異型ATL31(不活性型)-FLAGを発現する形質転換体 を用いることにしました。精製産物のMS解析の結果,複数の14-3-3タンパク質群が相互作用因子として同定されました。14-3-3タンパク質はリン 酸化された多様な酵素タンパク質に結合し,その活性を制御する分子です(図6)。その中でも,特にH+-ATPaseや硝酸還元酵素,グルタミン合成酵素,グルタ ミン酸合成酵素,スクロースリン酸合成酵素など,炭素・窒素代謝の主要な酵素群が14-3-3の結合により活性制御を受けることが知られており,C/N応 答との関連性が非常に高い制御因子です。
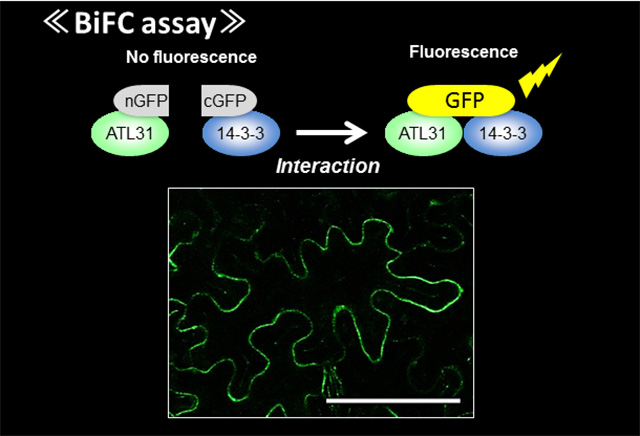
Co-IPや酵母2ハイブリッド等の解析に加え,蛍光タンパク質を用いたBiFC(Bimolecular Fluorescence Complementation)アッセイにより,ATL31と14-3-3が確かに植物の細胞膜上で相互作用していることが分かりました(図7)。加え て,in vitro 解析からATL31が直接的に14-3-3をポリユビキチン化することが示されました。また,14-3-3は実際にシロイヌナズナの発芽後成長時に ATL31制御下でC/Nストレスに応じて安定性が変動し,さらに14-3-3過剰発現体がC/Nストレス高感受性を示しました。これらの結果か ら,ATL31はC/Nに応じた14-3-3安定性の調節を介して,植物の発芽後成長を制御すると結論づけました。これにより,今まで不明であった高等植 物のC/N応答制御機構の一端が明らかになり,そこにはユビキチン-プロテアソーム系による特異的タンパク質分解が関与するという植物独自の栄養ストレス 応答機構が存在することが分かりました(Sato et al., Plant J, 2011, 68:137-146)。
現在は,ATL31と14-3-3の相互作用の制御メカニズムとその上流シグナル伝達経路 について解析を続けています。さらに,14-3-3の下流で具体的にどういった酵素の活性・代謝物量が制御され,植物のC/N応答が起こるかについて,先 端的なプロテオーム解析やメタボローム解析を駆使しながら,包括的に解き明かそうとしています。
.jpg)