Kurihara M. and Kimura A.P.
Characterization of the human TCAM1P pseudogene and its activation by a potential dual promoter–enhancer: Comparison with a protein-coding mouse orthologue
FEBS Letters 589: 540-547
PubMed HUSCAP
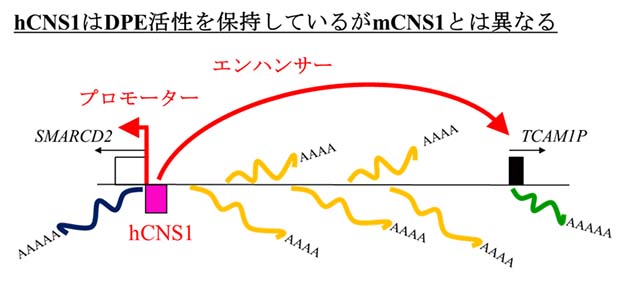
本研究は我々がマウスTcam1遺伝子座で発見したdual promoter-enhancer(DPE)に関する解析(Kurihara et al., 2014)に続くものであり、ヒトTCAM1P遺伝子座における各遺伝子の発現パターンとその調節メカニズムを解析したもので ある。まずヒトSMARCD2とTCAM1Pの発現パターンを解析した結果、マウスと同様にSMARCD2 mRNAは解析したすべての組織で発現が見られたのに対し、TCAM1P mRNAは精巣特異的であった(Fig. 1)。しかし、過去に行われたマイクロアレイのデータを解析したところ、精母細胞特異的なマウスTcam1と違って、ヒトTCAM1Pは精原細胞、精母細 胞、精細胞で発現が見られた。さらに、ヒトTCAM1PはマウスTcam1のように細胞接着タンパク質をコードする構造にはなっておらず偽遺伝子 化していたので、今回その転写産物のクローニングも行った。その結果、6種類の新たなTCAM1P転写産物を同定した(Fig. 2)。次に、マウスCNS1(mCNS1)と同様にヒトCNS1(hCNS1)がDPE活性を持つのかどうかレポーター解析によって検証した。さまざまな コンストラクトを3種類の異なる細胞種にトランス フェクションして解析したところ、hCNS1はどの細胞種においてもTCAM1Pプロモーター活性を有意に上昇させることがわかった(Fig. 3)。さらに、hCNS1は強いプロモーター活性を持つことがわかったが、その活性は一方向性であるようだった(Fig. 4)。それでも、両方向にある程度強いプロモーター活性を示したので、SMARCD2遺伝子とTCAM1P遺伝子の間の領域からlong noncoding RNAが転写されている可能性も検証した。その結果、この遺伝子間領域のほとんどの配列が精巣特異的に転写されていることがわかったが、調べ た限りではhCNS1をプロモーターとするものは見つからなかった(Fig. 5)。以上のようにhCNS1はDPE活性を保持しているもののmCNS1とは異なる性質を持つものであった。そこで最後に、さまさまな哺乳動物の CNS1配列を比較したところ、CNS1の性質がTCAM1の偽遺伝子化よりも前に変化していたことがわかった(Fig. 6)。本研究は、ヒトにおいてもDPEが存在することを示すものであると同時に、偽遺伝子や転写調節機構の進化に関する重要な知見を提供するものである。