研究のキーワードはこ ちら
研究に用いている実験手法はこ ちら
研究室構成員それぞれのテーマはこ ちら
ゲノム配列が解読されて久しい現在ですが、ゲノムの大部分を占めるタ
ンパク質をコードしない配列の機能はよくわかっていません。私たちは、そのような配列が
持つ機能を明らかにしようと考えて研究を行っています。
このような配列が持つ機能の中でも特に重要なものが「遺伝子の発現調節」になりま
す。ヒトやマウスにはタンパク質をコードする遺伝子が約2万個存在すると
されており、これらの遺伝子のうち必要なものが必要な時に必要な量だけ発現することによって
生命活動が正常に保たれます。したがって、この2万個の遺伝子の発現がどのようなメカニズムによって調節されているかを明らかにすることが重要なので
すが、残念ながら哺乳類ではそのメカニズムが非常に複雑であるために、まだまだ解明されたとは言いがたい状況です。私たちはその解明を目指していま
す。
一方で、生物種によってタンパク質をコードする遺伝子の数にはそれほ
ど大きな差がないという事実もあります。例えば、ワトソンの「遺伝子の分子生物学」
第
6版によると、タンパク質をコードする遺伝子の数は、ヒトが20000個、マウスが22000個、トラフグが22000個、線虫が20000個、キイロ
ショウジョウバエが14700個などとなっています。したがって、これらの遺伝子の発現パターンが種によってまったく異なるとしても、タンパク質をコード
する遺伝子だけで生物種の多様性を説明するのは難しいと思われます。この問題を解決するかもしれないのがnoncoding RNAです。
noncoding
RNAとはその名の通り、タンパク質をコードしない転写産物であり、21世紀に入ってから行われた数々のトランスクリプトーム解析(ある細胞や組織に含ま
れる転写産物を網羅的に配列決定する解析)によって発見され、注目を集めるようになりました。驚くべきことにヒトやマウスではゲノム配列の大部分が転
写されているというのです。ヒトの場合、タンパク質をコードする遺伝子(エクソンとイントロン)はゲノム全体の25%に過ぎないことから、私たちの体には
非
常に多くの
noncoding RNAが発現しているのです。私たちはnoncoding RNAのうち200塩基以上の長さを持つlong noncoding
RNAの機能解明を目指した研究も進めています。
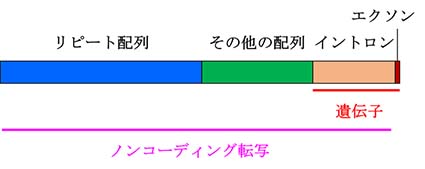
上の図はヒトゲノム配列の概要を示したものです。
以上私たちが目指すものに向かって、現在具体的に研究対象としている
のは生殖器官
です。生殖と発生は生命を次世代に伝えていくために最も重要な過程であり、生命の本質であると言ってもいいかもしれません。私たちは生殖と発生を担う重要
な器官(卵巣、精巣、胎盤)において、遺伝子の発現がどのようにして調節されているのか、そして、long
noncoding
RNAがどのような機能を持っているのか、について研究を行っているのです。
生殖を担う本体は卵と精子であり、これらをいかにして正常に作り出す
かは、生殖分野における大きな課題です。私たちのメインの研究テーマは、このうち精子を作り出す過程すなわち「精子形成」のメカニズムで
す。現代社会では6組に1組の夫婦が不妊に悩んでいると言われており、不妊の原因の半分は男性側にあることが知られています。したがって、精子形成のメカ
ニズムを理解することは不可欠なのですが、これまでの多くの研究者たちの努力にもかかわらず現代においてもわからないことがたくさんあるのです。私たちは精子形成中に起きる転写活性化と
いう現象に注目し
ていま
す。
哺乳類の精巣では精細管と呼ばれる管の中でセルトリ細胞に包まれた生
殖細胞が減数分裂を行います。精細管の中では精原細胞が有糸分裂を続けていますが、そ
のうちある割合の細胞が減数分裂を開始して一次精母細胞、二次精母細胞、精細胞へとかたちを変えていきます。一倍体の精細胞はその後精子変態という過程を
経て成熟した精子になり、やがて精細管の内腔へと放出されます。この一連の過程が「精子形成」なのですが、この中で減数分裂中に多くの重要な遺伝子が活性
化されることが知られているのです。特に一次精母細胞という時期には多くの遺伝子活性化が見られるのですが、なぜこれらの遺伝子がこの時期だけに活性化す
るの
かはわかっていないのです。そこで、私たちはマウス精巣を用いて、一次精母細胞で遺伝子が活性化するメカニズムを、
特に転写レベルで明らかにしようと研究
を行っています。
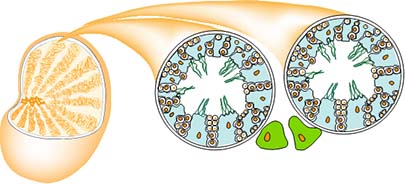
上の図はマウス精巣の模式図です。精巣には精細管と呼ばれる管が詰
まっていて、その中で精子形成が行われます。緑色の細胞は精細管の外に存在して男性ホル
モン(アンドロゲン)を産生するライディッヒ細胞です。
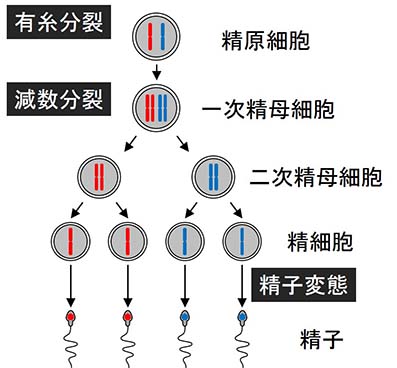
この図はマウスの精子形成を表したものです。有糸分裂によって増えた
精原細胞の一部が減数分裂に入り、その結果できた精細胞が精子変態によって精子になります。このうち一次精母細胞では精子形成に重要な多くの遺伝子が活性
化します。
① 転写活性化とは?
細胞には核が存在しており、その中にあるDNAの一部が遺伝子と呼ば
れる部分です。この遺伝子は必要な時にmRNAという物質に変換されますが、この過程を「転写」と呼びます。その後、mRNAは「翻訳」という過程を経て
タンパク質へと変換されて機能を発揮するのです。私たちは、一次精母細胞で活性化する遺伝子がどのようなメカニズムで転写されるのかを解明しようとしてい
ます。
② 転写活性化に必要なものは?
転写活性化には、DNA上に存在する「プロモーター」や「エンハン
サー」といった特別な配列に「転写因子」と呼ばれるタンパク質が結合することが必要で、私たちはもちろんその研究も行っています。しかし、私たちは、転写
活性化には他にも必要なものがあることを見出していて、それが「dual
promoter-enhancer(DPE)」と呼ばれる多機能性のDNA配列であり、long noncoding
RNA(lncRNA)なのです。以下、この2つについて説明します。
③ dual promoter-enhancer(DPE)について
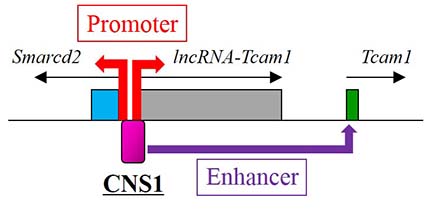
dual
promoter-enhancer(DPE)とは同時にプロモーターとしてもエンハンサーとし
ても機能する、つまり一人二役をこなすことのできるDNA配列で、私たちの研究によって哺乳類にも存在することが明らかになりました(Kurihara
et al., 2014)。私たちが発見したDPE(下図のCNS1)はマウスの一次精母細胞で同時に3つの遺伝子を調節するというもので、そ
の後の研究でヒトで
もそのような機能を持つDNA配列があることがわかりました(Kurihara
et al., 2015)。DPEは同時に複数の遺伝子を調節するので、1つの機能しか持たないDNA配列よりも重
要性が高いと考えられます。そこで、私たちは現在マウスの精子形成で機能するDPEを網羅的に同定して解析する研究を行っているところです。この研究に
よって精子形成調節メカニズムの新たな一面が明らかになるかもしれません。
④ long noncoding RNA(lncRNA)について
上述したようにlncRNAとは200塩基以上の長さを持ち翻訳され
ずに機能するRNAのことです。哺乳類のあらゆる器官・組織でその存在が確認されており、核や細胞質で多様な機能を持つことが知られています。精巣は多く
の器官の中でも特にたくさんのlncRNAを発現していることが知られていて、その機能に注目が集まっているのです。私たちは、精巣だけで機能する多くの
lncRNAを発見してそれらの解析を行っているのです。以下、いくつかの例を紹介します。
lncRNA-Tcam1:
上述したDPEが調節する3つの遺伝子のうちの1つです(Kurihara
et al., 2014)。私たちの研究から、精子形成中に精巣が感染した際の防御に機能することが示唆されています(Kurihara
et al., 2017)。
lncRNA-HSVIII:
私たちが研究を行っているPrss/Tessp遺伝子座から発見しました。この遺伝子座には精巣だけで機能するプロテアーゼ(タンパク質分解酵素)を
コードする遺伝子が6つ並んでいて、精子形成には極めて重要なゲノム領域となっています。私たちはこれらプロテアーゼ遺伝子の間からlncRNA-
HSVIIIが転写されていることを発見しました。lncRNA-HSVIIIは精巣のみで発現していて、減数分裂過程で核から細胞質へ局在を変化させる
ことがわかっています(Yoneda,
Satoh et al. 2016)。
Tesra:
こちらもPrss/Tessp遺伝子座から転写される精巣特異的なlncRNAです。Tesraはこの遺伝子座に存在するPrss42/Tessp-2
遺伝子のプロモーターに結合してその転写活性を増強することがわかりました(Satoh
et al.,
2019)。Prss42/Tessp-2は減数分裂の進行に重要な遺伝子ですので(Yoneda
et al. 2013)、Tesraも減数分裂の進行に重要であると考えられます。また、Tesraは細胞外小胞にも存在することが明らかにな
り、その機能も注目されるところで
す。
卵巣では卵が作られますが、その過程を「卵形成」と呼びます。哺乳類で
は出産前の卵巣で卵が減数分裂を開始し、一次卵母細胞で止まった卵が蓄えられます。これらの卵は思春期以降にホルモンなどの調節によって成熟して排卵に至
ります。この時、脳下垂体からのホルモン刺激に応答して自らもホルモン産生するのが、卵を取り囲んでいる顆粒膜細胞な
のです。したがって顆粒膜細胞は卵形成において極めて重要な役割を持つのですが、その機能を発揮するために不可欠である遺伝子発現の調節メカニズムはよく
わかっていないのです。私たちは顆粒膜細胞で高発現するいくつかの遺伝子について、その転写活性化メカニズムを解明するための研究を行っています。
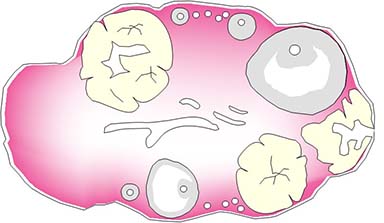
上の図はマウス卵巣断面の模式図です。卵は顆粒膜細胞に囲まれた濾胞という構造の中に存在しており、ホルモン刺激などによって成熟・排卵されます。排卵後
の濾胞は黄体という構造になります。
① POP遺伝子座
POP(プロリルオリ ゴペプチダーゼ、prolyl oligopeptidase)はプロリン残基を認識してペプチドを切断するセリンプロテアーゼ(活性中心 にセリンを持つタンパク質分解酵素)で、細菌から哺乳類まで存在し、哺乳類ではほとんどすべての器官で発現が見られる重要分子です。しかしその発現量は組 織によって異なっていて、マウスでは卵巣の顆粒膜細胞で特に高い発現が見られます。POPはこれまでの研究で多くの生理機能が示されてきたのですが、正し い機能を発揮するために不可欠であるはずの「適切な時期に適切な量の遺伝子発現を行うためのメカニズム」つまり「POP遺伝子の発現調節メカニズム」はほ とんどわかっていないのです。そこで私たちは卵巣の顆粒膜細胞を中心にして、POP遺伝子の転写活性化メカニズムを研究しています。
これまでにわかったことは主に3つです。1つ目は、エクソン15付近のCpGアイランドと呼ばれるCG配列に富んだ領域がエンハンサー活性を持っていて、 その活性がDNAメチル化によって調節されることです(Matsubara et al., 2010)。2つ目は、914塩基のPOPプロモーター配列がin vivoにおいて、クロマチンの位置効果を受けなければ胎盤における転写活性化に十分であることです(Matsubara et al., 2013)。この結果は同時に、顆粒膜細胞での発現にはプロモーターだけでは不十分であることも示しています。そして3つ目は、 顆粒膜細胞においてPOP遺伝子の転写活性化にlncPrep+96kbとい うlncRNAが機能することです(Matsubara et al., 2014)。
つまり、卵巣の顆粒膜細胞においてPOP遺伝子は、プロモーターだけでは転写活性化されず、少なくとも1つのエンハンサーと1つのlncRNAによる調節 を受けている、ということになります。実はPOP遺伝子は癌細胞で非常に高い発現を示すこともわかっており、POP遺伝子の発現調節メカニズムを解明する 先には、そのような細胞の異常な増殖の原因究明にもつながっていくかもしれません。
② Amhr2遺伝子座
Amhr2(Anti -Müllerian hormone tyep II receptor)は抗ミュラー管ホルモン(AMH、Anti- Müllerian hormone)の受容体で、哺乳類の成体では卵巣の顆粒膜細胞と精巣のセルトリ細胞とライディッヒ細胞で特異的に発現します。つまり組織特異性が、ほぼ すべての組織で発現するPOP遺伝子とは大きく異なるわけですが、卵巣の顆粒膜細胞で高発現するという点は共通しています。私たちは、顆粒膜細胞での遺伝 子活性化をさらに調べるためにAmhr2遺伝子の転写活性化メカニズムについても研究しています。
これまでにわかったことは主に2つです(Kimura et al., 2017)。1つ目は、これまで重要であると考えられてきた500塩基のプロモーターが、in vivoでは卵巣でも精巣でも転写活性化に不十分であることです。そして2つ目が、Amhr2遺伝子の上流から転写されるlncRNA-Amhr2と名 づけたlncRNAが、少なくとも卵巣の顆粒膜細胞でAmhr2遺伝子の転写活性化に機能することです。現在は、このlncRNAがどのようなメカニズム でAmhr2遺伝子を活性化するのか、などについて研究しているところです。
③ その他
卵巣の顆粒膜細胞についてはこれらの他に、さらに別な遺伝子の調節メカニズムや脳下垂体からのホルモンによる調節メカニズムなどについても研究を発展させ ようとしています。

① POP遺伝子座
POP(プロリルオリ ゴペプチダーゼ、prolyl oligopeptidase)はプロリン残基を認識してペプチドを切断するセリンプロテアーゼ(活性中心 にセリンを持つタンパク質分解酵素)で、細菌から哺乳類まで存在し、哺乳類ではほとんどすべての器官で発現が見られる重要分子です。しかしその発現量は組 織によって異なっていて、マウスでは卵巣の顆粒膜細胞で特に高い発現が見られます。POPはこれまでの研究で多くの生理機能が示されてきたのですが、正し い機能を発揮するために不可欠であるはずの「適切な時期に適切な量の遺伝子発現を行うためのメカニズム」つまり「POP遺伝子の発現調節メカニズム」はほ とんどわかっていないのです。そこで私たちは卵巣の顆粒膜細胞を中心にして、POP遺伝子の転写活性化メカニズムを研究しています。
これまでにわかったことは主に3つです。1つ目は、エクソン15付近のCpGアイランドと呼ばれるCG配列に富んだ領域がエンハンサー活性を持っていて、 その活性がDNAメチル化によって調節されることです(Matsubara et al., 2010)。2つ目は、914塩基のPOPプロモーター配列がin vivoにおいて、クロマチンの位置効果を受けなければ胎盤における転写活性化に十分であることです(Matsubara et al., 2013)。この結果は同時に、顆粒膜細胞での発現にはプロモーターだけでは不十分であることも示しています。そして3つ目は、 顆粒膜細胞においてPOP遺伝子の転写活性化にlncPrep+96kbとい うlncRNAが機能することです(Matsubara et al., 2014)。
つまり、卵巣の顆粒膜細胞においてPOP遺伝子は、プロモーターだけでは転写活性化されず、少なくとも1つのエンハンサーと1つのlncRNAによる調節 を受けている、ということになります。実はPOP遺伝子は癌細胞で非常に高い発現を示すこともわかっており、POP遺伝子の発現調節メカニズムを解明する 先には、そのような細胞の異常な増殖の原因究明にもつながっていくかもしれません。
② Amhr2遺伝子座
Amhr2(Anti -Müllerian hormone tyep II receptor)は抗ミュラー管ホルモン(AMH、Anti- Müllerian hormone)の受容体で、哺乳類の成体では卵巣の顆粒膜細胞と精巣のセルトリ細胞とライディッヒ細胞で特異的に発現します。つまり組織特異性が、ほぼ すべての組織で発現するPOP遺伝子とは大きく異なるわけですが、卵巣の顆粒膜細胞で高発現するという点は共通しています。私たちは、顆粒膜細胞での遺伝 子活性化をさらに調べるためにAmhr2遺伝子の転写活性化メカニズムについても研究しています。
これまでにわかったことは主に2つです(Kimura et al., 2017)。1つ目は、これまで重要であると考えられてきた500塩基のプロモーターが、in vivoでは卵巣でも精巣でも転写活性化に不十分であることです。そして2つ目が、Amhr2遺伝子の上流から転写されるlncRNA-Amhr2と名 づけたlncRNAが、少なくとも卵巣の顆粒膜細胞でAmhr2遺伝子の転写活性化に機能することです。現在は、このlncRNAがどのようなメカニズム でAmhr2遺伝子を活性化するのか、などについて研究しているところです。
③ その他
卵巣の顆粒膜細胞についてはこれらの他に、さらに別な遺伝子の調節メカニズムや脳下垂体からのホルモンによる調節メカニズムなどについても研究を発展させ ようとしています。
ゲノム機能とは直接関係ありませんが、プロテアーゼ機能の解析も行っ
ています。プロテアーゼ(タンパク質分解酵素)とは、その名の通りタンパク質を分解する酵素の総称です。ゲノム配列が解読された結果、ヒトでは553個
の、マウスで
は628個のプロテアーゼ遺伝子(類似する遺伝子も含む)が存在することがわかりました(Puente et al.,
Nature Rev. Genet. 4: 544, 2003)。プロテアーゼは、その活性中心を構成するアミノ酸の種類や活
性を発揮
するために必要となる因子から、セリンプロテアーゼ、アスパラギン酸プロテアーゼ、システインプロテアーゼ、メタロプロテアーゼに分類され、ヒトやマウス
ではセリンプロテアーゼに分類されるものが最も多く存在します。実は上述したPrss/Tessp遺伝子群とPOP遺伝子がいずれもセリンプロテアーゼに
分類されることと、これらが機能する精子形成と胎盤分化がいずれもプロテアーゼ研究の遅れている分野であることから、私たちはこれらの機能解析も行ってい
るのです。
① 精子形成におけるPrss/Tessp遺伝子群
私たちはPrss/Tessp遺伝子座に存在する3つのプロテアーゼ
遺伝子と、別な染色体に存在する1つのプロテアーゼ遺伝子について機能解析を行っています。これらの遺伝子はもともと高橋孝行教授によって発見されたもの
で、別の遺伝子座に存在するPrss41/Tessp-1遺伝子についてはすでにその発現概要が報告されていました(Takano et al., Mol.
Reprod. Dev. 70: 1-10, 2005; Takano et
al., Zoolog. Sci. 26: 294-300,
2009)。私たちはそのデータをもとにして解析を続けたところ、この遺伝子は精原細胞が一次精母細胞に進行する過程で役割を持つ
ことがわかってきました
(Yoneda
and
Kimura,
2013)。
また、残りの3つのPrss/Tessp遺伝子については、3つが互いに異なる機能を持つことがわかったうえ、Prss42/Tessp-2と
Prss43/Tessp-3が一
次精母細胞から精細胞までの進行に重要であることがわかりました(Yoneda
et al.,
2013)。これらPrss/Tessp遺伝子の研究をさらに続けていくことで、精子形成メカニズムの全容解明へとつなげていきたいと考えていま
す。
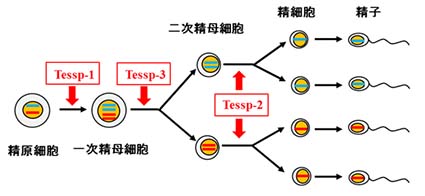
上の図はこれまでにin vitro精子形成系を用いて明らかになった、各Prss/Tessp遺伝子の役割を示したものです。減数分裂の各段階の進行に必要であることがわかり ました。
② 胎盤分化におけるPOP遺伝子
胎盤は哺乳類の中でも真獣類のみが持つ器官です。胎盤は妊娠中に母体
と胎児の間で栄養交換を行うためにとても重要な器官ですが、その形成過程や機能発現に
関するメ
カニズムは不明な点が数多く残されています。私たちは、マウス胎盤において高発現を示すPOPが胎盤においてどのような機能を持つか調べることを通して、
胎盤分化におけるプロテアーゼ
機能の解明を目指しています。
上述したようにPOPは特殊な活性を持つセリンプロテアーゼで、古く
から脳において学習と記憶の調節や脳神経疾患への関わ
りが注目されてきました。しかし近年の研究では、POPがさまざまな組織でさまざまな生命現象に関わる多機能性の分
子であることがわかっていて、中でも注目されている機能が細胞分裂や細胞分化の調節です。私たちは、胎盤におけるPOPの発現パターンから、マウスPOP
が胎盤分化の調節に関わる可能性があると考えて研究を進めています(Matsubara
et al.,
2011)。これまでに、胎盤の幹細胞であるTS細胞(Trophoblast
Stem
Cell)を用いて、POPがTGC(Trophoblast Giant
Cell)とSpT(Spongiotrophoblast)と呼ばれる細胞への分化調節に機能することを明らかにしました(Maruyama
et al., 2017)。現在はその分子メカニズムの解析を行っており、これまで知見の少なかった胎盤プロテアーゼ機能の一端を解明しようと
しています。

上の図はマウス胎盤の模式図です。この図では上側が母親の子宮に結合していて、下側は(図にはありませんが)臍帯を通じて胎児とつながっています。母親側 から、maternal decidua、junctional zone、labyrinthという3つの層に分かれているのが特徴です。
研究というものは当初思い描いていた方向に進まないことも多く、そのため上述した以外にも新しい研究テーマが生まれています。我々はこのような突発的に生 まれたテーマも可能であれば追求することにしています。